
QINMS.com || 首页 ||
Validity(有效性、合法性、正确性)
“医学产品必须实现厂商承诺的性能,特别如:分析灵敏度、诊断灵敏度、分析特异性、诊断特异性、准确度、可重复性(repeatability)、可重现性(reproducibility)、包括控制已知的相应的干扰、以及检测限等。”
Traceability(溯源性)
“通过具有的参考检测方法,和/或具有的较高级的参考品,必须保证对校准品和/控制品定值的溯源性。”
确认(Validation)是肯定方法满足了预期的目的。
证实(Verification)是肯定了方法满足使用说明书中承诺的有效性(Validity)。
厂商将确认它们的常规方法,并在使用说明书中承诺其有效性。
实验室只需要核实(verify)厂商常规方法的有效性。如果实验室使用自己发展的方法、或对厂商的方法进行修改,则实验室需要和厂商一样的方式,对“自己”的方法予以确认。
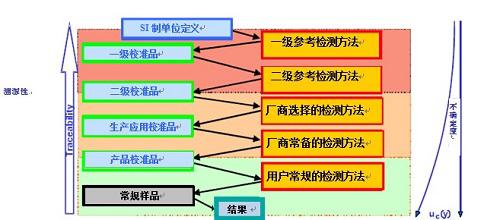
溯源至参考方法
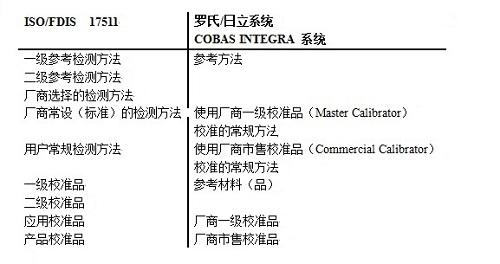
ISO/FDIS 17511(“校准品和控制品定值的计量溯源性”)和ISO/FDIS 18153(“校准品和控制品的酶催化浓度定值的计量溯源性”)标准规定了如何保证检测中真实确立校准品和控制品定值的计量溯源性。
溯源性的理想终点链,最高级的计量级,将包括SI单位定义和叙述一级参考检测方法和一级校准品。
使用一级/国际参考检测方法、一级/国际校准品、或若没有以上二者,使用厂商选择的检测方法给厂商的应用校准品定值,后厂商的应用校准品将具有使用厂商确定的检测方法的定值,用于常规方法。
产品校准品定值的不确定度来自一级参考检测方法、确定的检测方法和常规方法。
溯源性链将保护常规方法得到的患者结果和由参考方法或参考品得到的结果具有可比性。
标准化:
标准化的步骤如下:
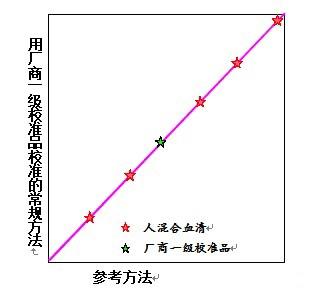
1a) 厂商一级校准品可溯源至参考方法。
以厂商一级校准品校准参考方法 和常规方法,然后,这两个方法同时对5个人混合血清组和一级校准品定值。对厂商一级校准品的定值,被作了调整,使斜率=1和截距=0。
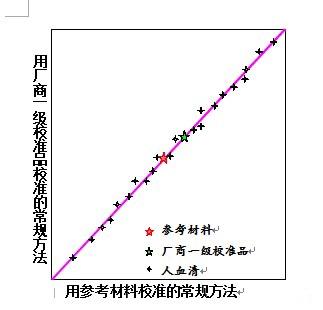
1b) 厂商一级校准品可溯源至参考材料。
使用参考材料和厂商一级校准品分别对常规方法进行校准后,对数个人血清和厂商一级校准品定值。调整厂商一级校准品的定值,这样,斜率=1和截距=0。
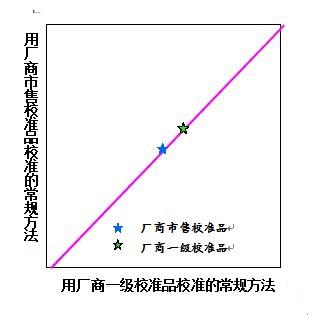
2) 厂商市售校准品可溯源至厂商一级校准品。
使用厂商一级校准品校准常规方法,对厂商市售校准品定值。
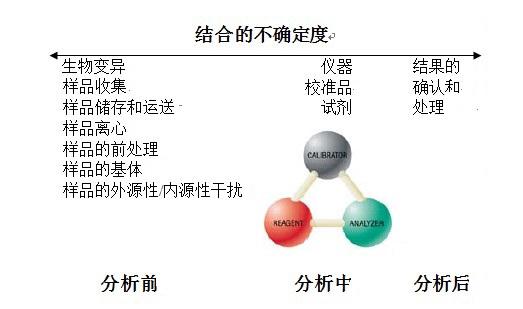
结合的不确定度
用常规方法得到的患者结果,受到分析前、分析中、和分析后的影响。每一个分析阶段都对结果给予某些不确定度。其中,分析前的不确定度是主要内容。
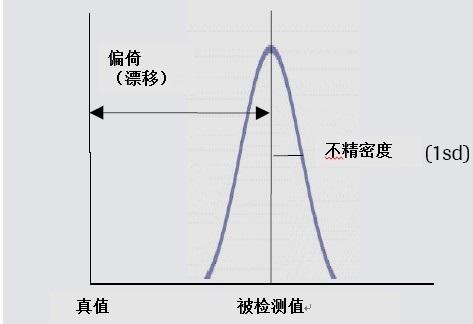
分析的不确定度
来自分析的不确定度包括检测中的真实行为不和精密度二者。分析不确定度=偏倚 + 不精密度
来自仪器、试剂、和校准品的不确定度,在计算分析不确定度时需要予以考虑。校准品定值的不确定度,按照检测不确定度表达的导则(the Guide to the Expression of Uncertainty in Measurement〔GUM 1993〕)计算扩充的不确定度,覆盖因子k = 2(相当于95%可信限水平,2sd和正态分布)。
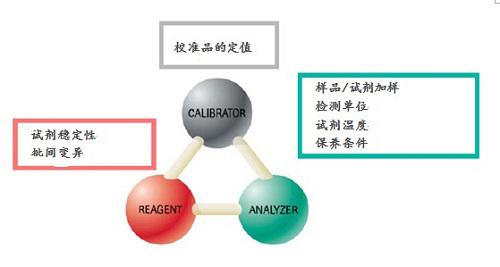
校准品定值的不确定度,对每批校准品都作计算。尽管每批校准品的批间不确定度差异很小,但是,公司仅对一批校准品陈述“溯源性和不确定度说明”。
该批校准品被选择在“溯源性和不确定度说明”中,因为一些典型的分析物浓度有典型的不确定度。