
QINMS.com || 首页 ||
六、蛋白质凝胶电泳
聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE),是目前对蛋白质进行分离、纯度鉴定及分子量测定的主要方法之一。十二烷基磺酸钠(SDS)是一种阴离子去污剂,可与蛋白质结合,使蛋白质变性并带上大量负电荷。SDS-PAGE是最常用的凝胶电泳技术。它通常采用不连续电泳系统,即用上层胶(成层胶)和下层胶(分离胶)两种不同浓度的凝胶灌制凝胶板,见图2.SDS-PAGE通过其电荷效应、浓缩效应和分子筛效应,达到蛋白质高分辨率的分离效果。
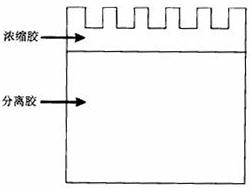
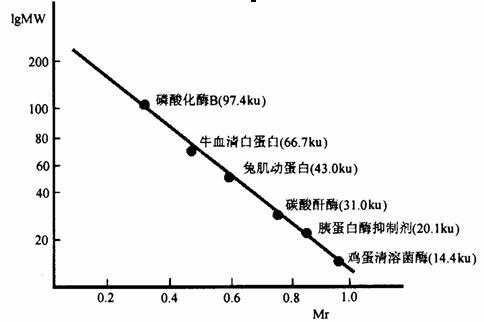
待分离蛋白质样品在电泳中的泳动速度,或相对迁移率(Mr)与蛋白质本身性质(如分子大小)、凝胶孔径和电泳条件(如电流、电压)等密切相关,蛋白质结合大量的SDS后,各组分之间的的形状和电荷差异被抵消,此时蛋白质在电场中泳动速度的快慢,仅与各自分子量的大小有关。因此,可根据下列公式计算分子量大小:
lgMW=lgK—bMr
其中,MW为蛋白质的分子量,K为常数,Mr为相对迁移率,b为斜率。将已知分子量的几种标准蛋白质在电泳中的相对迁移率对其分子量的对数做图,即可得到一条蛋白质分子量校正曲线。根据待测样品的相对迁移率,可由校正曲线查到其分子量大小,蛋白质样品中加SDS煮沸后,蛋白质发生变性,为保护和还原二硫键,尚需加还原剂2-巯基乙醇(2-ME)或二硫苏糖醇(DTT)。蛋白质变性使亚基聚合形式存在的蛋白质解聚成单个亚基。因此,对于一个纯化蛋白质,可经SDS-PAGE确定其亚基种类、数目及大小。上述蛋白质分子量测定更确切地说是蛋白质分子各亚基分子量的大小。
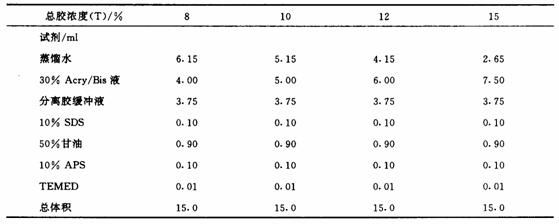
丙烯酰胺凝胶孔径对电泳速度及分离效果影响很大。凝胶孔径的大小取决于丙烯酰胺(Aery)单体及N,N—亚甲基双丙烯酰胺(Bis)的含量及比例。总胶浓度(T)可在3%~30%范围内变动,T为8%~15%的凝胶,适用于大多数蛋白质样品的分离。交联度(C)是反映凝胶聚合情况的一个指标。凝胶聚合过程中,Acry单体之间形成延伸的多聚链,并通过Bis的作用,连接和交叉成网状结构,最终成为肉眼可见的凝胶。催化剂过硫酸铵(APS)和加速剂四甲基己二胺(TEMED)直接影响凝胶聚合质量。二者加量过多,会使Acry单体聚合链较短,聚合不充分,胶的脆性增加;反之,如加量过少,则聚合速度大大降低,甚至只出现所配制的胶溶液黏度稍增加、无胶状物出现的现象。见图3.
根据电泳的目的和要求及样品的特点,可采取恒流或恒压条件进行电泳。
由于印迹技术需将蛋白质成功地从胶中转移至膜上,因此,选择合适的凝胶甚为重要。一般情况下,丙烯酰胺和交联剂的比例越低,转移就越易进行。超薄胶转移的速度快,而且彻底。通常,应根据目的选择厚度、大小均适合的凝胶。若想寻求蛋白质的最佳分辨力,长胶的效果较好,使较大分子量的蛋白质更好地分离。若想达到最大的灵敏度,胶的厚度可增加到1.5mm,并且在不发生变形的前提下,尽量提高蛋白的上样量。若主要考虑的是分离速度,则选用微型胶,厚度为0.5mm。表1显示SDS聚丙烯酰胺凝胶的有效分离范围。

试剂与器材
(1)Acry/Bis贮存液:29.2gAcry,0.8gBis,加60m1双蒸水充分溶解后,再加双蒸水至100ml。过滤后,于4℃避光保存。
(2)分离胶缓冲液:1.5mol/L Tris-HCl,pH8.8:18.15g Tris,溶于60ml双蒸水中,用1mol/L HCl调pH至8.8,加双蒸水至100ml,于4℃保存。
(3)成层胶缓冲液:0.5mol/L Tris-HCl,pH6.8:6.0g Tris,溶于60ml双蒸水中,用 1mol/LHCl调pH至6.8,加双蒸水至100ml,于4℃保存。
(4)10%APS:1.0g APS加10ml双蒸水溶解,一20℃分装冻存,或新鲜配制。
(5)TEMED:原液。
(6)10%SDS:10g SDS溶于80m1双蒸水中,加热搅拌至完全溶解,定容至100ml。室温保存。
(7)50%甘油:50ml甘油加50ml双蒸水,配成100ml溶液。
(8)样品缓冲液(6X):成层胶缓冲液1.Oml,50%甘油0.8ml,10%SDS 1.6ml,2-ME0.4ml,0.05%溴酚蓝0.2ml,双蒸水4.0ml。混合均匀后,分装冻存。
(9)电极缓冲液(1X):pH8.3:3.03g Tris,14.4g甘氨酸,1.0g SDS,加双蒸水至1000ml。
(10)蛋白质分子量标准晶:蛋白质分子量标准(高分子量和低分子量)均有商品供应。
(11)垂直板电泳装置:电泳槽。
(12)电泳仪。
(13)玻璃微量进样器:加样枪配扁而长的加样头亦可。
操作步骤
(1)将两块玻璃扳组成的灌胶模具(其中一块上口带有凹槽,另一块内面两侧粘有凝胶板隔离胶条,胶条厚度为0.5mm、0.75mm、1.0mm,按所需凝胶厚度选择)洗净、晾干,按图4安装好。
2)选择合适的分离胶浓度,按表2配制所需分离胶溶液。
(3)将分离胶液混合后缓慢倒入玻璃板之间,并即刻在胶表面用滴管沿凝胶板内壁滴加2~3mm高的水饱和正丁醇(无水乙醇亦可),以防止空气中的氧扩散进入胶液,影响聚合(胶液与正丁醇分界面可见清晰的折光线)。
(4)待分离胶聚合后(约30~40分钟),倾去表面液体,用少量分离胶缓冲液洗2~3次,多余的液体用滤纸条吸干。
(5)配制成层胶缓冲液:3.05ml双蒸水,0.65ml Acry/Bis液,1.25ml成层胶缓冲液,50μl 10%SDS 50μl 10%APS,5μl TEMED。总体积5.0ml,T为4%。
(6)将成层胶液混合后,缓慢加到分离胶表面,至凹口玻璃板上缘。小心插入梳子(梳子应在步骤1安装完毕后,预先试一下是否合适),注意排除气泡。
(7)30分钟至1小时后,小心拔出梳子,去掉四周封闭乳胶管,将凝胶板与上、下电泳槽连接好。
(8)上层电泳槽中加电极缓冲液没过加样孔,并用电极缓冲液冲洗加样孔。如个别孔发生扭曲,可将玻璃微量进样器针头插入孔中,把孔间的短胶柱推正。
(9)待测蛋白质溶液中按1:4比例加样品缓冲液,如为沉淀及冻干粉,样品缓冲液应稀释4~5倍后加入,并使样品充分溶解。蛋白质分子量标准按商品说明书处理。沸水浴中煮3~5分钟后上样。
(10)恒压电泳。样品在成层胶中泳动时,电压为100V,进入分离胶后,电压增至150~200V(约15V/em)。为防止电泳产热过多,应外接冷却水装置。
(11)当样品缓冲液中的溴酚蓝指示剂移至凝胶底部时,终止电泳(约3小时左右)。取出凝胶板,小心将两板之间的胶移至较大的表面皿中。此凝胶可直接进行染色观察;亦可进一步通过免疫印迹技术,对待测蛋白质进行检测。
注意事项
(1)分离胶中加入少量甘油可增加胶的柔韧性,使胶不易破裂。
(2)配制胶液时,最后加APS和TEMED,加入后即刻使胶液充分混合,但要防止剧烈摇晃而产生气泡。
(3)表中所加试剂的量是依据灌制面积为14cm×l4cm,厚度为1mm的凝胶而设定,其他规格的凝胶板试剂用量可参考此表,进行适当调整。
(4)Acry、Bis具有神经毒性,实验中应带手套操作。
(5)可选用恒流条件进行电泳,如:样品在成层胶中泳动时,电流为30mA,进入分离胶后,电流增加至40mA;亦可以4~5mA低电流,电泳过夜,次日增加电流至10~12mA 5~10分钟,以改善样品的少量扩散。
(6)待分离样品的质、量直接影响电泳效果,如:若电泳出现波浪线,则说明上样量过多,应减少上样量;若样品中含盐浓度过高,应先透析,以便除掉盐分;若样品黏度过大(如细胞蛋白质),最好先用超声波破碎染色体DNA后再电泳。
(7)如果待分离样品中蛋白质组分分子量的变化幅度大,则应考虑用梯度发生器制备5%~20%的梯度胶,以达到满意的分离效果。
上一页【1】【2】【3】【4】【5】[6]【7】【8】【9】【10】【11】下一页