
QINMS.com || 首页 ||
七、将蛋白质从凝胶中转印致膜上
电泳后蛋白质样品转移的方法,包括半干式转移、湿式转移等。各种转移方法原理相似,都是将膜与胶放在中间,上下加滤纸数层,做成"Sandwich”样的转移单位,并且保证带负电的蛋白质向阳极转移,即膜侧连接阳极或面向阳极。
可用于免疫印迹的固相载体有多种,硝酸纤维素膜、尼龙膜、带正电荷的尼龙膜及PVDF(聚亚乙烯双氧化物)膜。硝酸纤维素膜最为常用,具有结合能力强,膜不需要活化,背景浅,能进行多次免疫检测并可用常规染色方法,功能基团寿命长等优点,但极易破碎不易操作。尼龙膜软且结实,较硝酸纤维素膜易操作,具有与蛋白质或蛋白质-去污剂混合物有很高的结合力,每平方厘米可结合480pg蛋白(而硝酸纤维素膜只能结合80Pg),因此灵敏度高,背景也高,因为其高电荷密度使对其非结合区进行封闭较为困难。带正电荷的尼龙膜能有效地结合低浓度的小分子蛋白,酸性蛋白、糖蛋白和蛋白多糖,当转印液中有SDS时,蛋白质容易从膜上泄漏,用甲醇固定能提高蛋白质在尼龙膜上的保留指数。PVDF膜在制备多肽供蛋白质化学分析中最为常用。在进行蛋白水解和序列分析时,通常是先将蛋白质结合在PVDF膜上。
将凝胶中的蛋白质转印至膜上的方法很多。目前常用方法是电洗脱或电印迹。其主要优点是转印迅速、完全。电洗脱有两种方法:一种是湿转印法,即将凝胶-膜夹层组合完全浸入转印缓冲液中;另一种是半干转印法,即将凝胶-膜夹层组合放在浸有转印缓冲液的吸水纸之间。前者是将夹层组合放人有铂丝电极的缓冲液槽中。而后者是将凝胶-膜夹层组合置于两个石墨平板电极之间。这两种转印的装置效果均较好,可根据实验室条件来选择。
试剂与器材
(1)电泳凝胶。
(2)转移缓冲液:pH8.1—8.4:3.03g Tris,14.4g甘氨酸,200ml甲醇充分溶解后,加双蒸水定容至1000ml。
(3)TBS缓冲液:1.21g Tris,8.77gNaCl,加HCl调pH至7.4,加水定容至1000ml。
(4)TTBS缓冲液:在TBS中加入Tween—20,浓度为0.1%,4℃保存1个月。
(5)封闭液:1.5g脱脂奶粉溶于50ml TTBS中,现用现配(用1%~3%的BSA,或10%胎牛血清亦可)。
(6)特异单克隆抗体:用封闭液适当稀释。
(7)酶标第二抗体:辣根过氧化物酶(HRP)或碱性磷酸酶(AKP)标记。
(8)蛋白质转印膜:NC(硝酸纤维素)膜、PVDF(聚偏二氟乙烯)膜,或尼龙膜等均可。
(9)显色底物。
(10)恒温振荡器。
(11)半干式电泳凝胶转移仪。
(12)Whatman 3mm滤纸。
(13)手套。
(14)孵育及显色用塑料盒。
(15)塑料袋。
(16)塑料封口机
操作步骤(半干式转移)
1.转移
(1)电泳后的凝胶先切除成层胶及需要进行凝胶直接染色的孔道部分,并将胶剪一小角作为定位标记,然后放在转移缓冲液中平衡30分钟左右。
(2)将转印膜1张及6张Whatman滤纸剪成与胶同样大小。转印膜用前需在转移缓冲液中平衡10~15分钟,滤纸用前在转移缓冲液中浸湿即可。
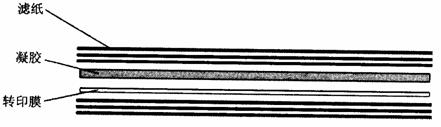
(3)由下至上将3层滤纸、膜、凝胶及3层滤纸依次放好。每放一层都应注意排除气泡。如有气泡,可用光滑的玻璃棒或试管在各表面缓慢滚动,予以排除。
(4)将转移装置连接好,接通电源。恒流下转移,0.8mA/cm2,转移30分钟至1小时。
(5)关闭电源,取出膜,然后用双蒸水漂洗l~2分钟,放在滤纸中干燥备用。注意膜上要做好标记。
2.检测
(1)将膜放在塑料盒中,加入适量封闭液,于37℃恒温振荡器上放置1小时,或4℃过夜。
(2)将膜转入塑料袋中,加入用封闭液稀释的第一抗体,于37℃或室温孵育反应1小时。
(3)剪开塑料袋,倾去第一抗体液体,用镊子将膜移至塑料盒中,加TBS洗3次,每次15分钟。
(4)加入稀释好的酶标第二抗体,继续在37℃或室温孵育反应30分钟至1小时。
(5)同步骤(3),洗膜。
(6)加底物显色液。此步骤一般要求避光进行。最好即时检查一下,以控制显色程度,防止本底过高及出现非特异条带。
(7)终止反应,用双蒸水大量冲洗,然后将膜放于双层滤纸中干燥保存。
注意事项
(1)如采用PVDF膜,使用前应在甲醇中浸泡一下,再移至转移缓冲液中平衡。另外,PVDF膜在检测时,采用TTBS缓冲液。
(2)电泳凝胶一般可重复转移1次,以获得两张相同的膜,第2次转移的时间可略延长。
(3)如待分析的蛋白质分子量大,转移时间也需延长。
(4)上述显色检测方法仅给出了基本步骤,采用不同检测系统,需按厂家说明书具体操作。
(5)电泳转移操作时,保证滤纸、膜、凝胶其间无气泡存在是实验的关键步骤。因即或有微小的气泡残留,电泳时局部温度升高,气泡膨胀会严重影响印迹结果。
上一页【1】【2】【3】【4】【5】【6】[7]【8】【9】【10】【11】下一页